生病时,医生往往给我们开了多种药物,这些药物在同时服下时是否因为药物间相互作用产生对身体不良的效果,这引起我们的怀疑和担心。其实医生所开的药方的药品已经经过了药物间相互作用的实验和临床测试,我们不应对此产生疑虑。
药物间相互作用(DDI)是指当一个患者同时服用多种药物时,药物之间可能发生的反应,这些反应可能会影响药物的效果和安全性,甚至导致严重的不良后果。所以预测和避免 DDI 是药物研发和临床治疗中的一个重要问题。但是由于药物的种类和数量庞大,以及 DDI 的复杂性和多样性,要通过实验和临床测试来检测所有可能的 DDI 是非常困难和昂贵的。因此利用人工智能(AI)技术来预测 DDI 是一种有效和快速的替代方案。
近年来,AI 领域的深度学习技术在处理图像、文本、语音等多种类型的数据方面取得了突破性的进展,为 DDI 预测提供了新的思路和方法。其中,卷积神经网络(CNN)是一种强大的深度学习模型,能够从数据中自动提取特征,并进行分类、回归、聚类等任务。CNN 在图像处理方面的优势已经被广泛证明,但是它也可以用于处理其他类型的数据,如药物的化学结构、酶、途径和靶点等。通过将不同类型的数据作为 CNN 的输入,并将它们融合为一个统一的输出,可以实现对 DDI 的多模态分析和预测。
本文介绍了一篇最新发表在著名《自然》杂志Scientific Reports上的论文,该论文提出了一种基于多模态 CNN 的 DDI 预测方法,称为多模态 CNN-DDI。该方法利用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。该方法在 DrugBank 数据库上进行了实验,该数据库包含了 572 种药物和 74528 个相互作用。该方法在准确率和 AUPR 等评估指标上均优于其他方法,并且能够有效地识别不同类型的 DDI。该方法对于药物的安全性和有效性具有重要的意义,也为药物的机制和功能的研究提供了一个新的视角和方法。
论文作者是来自巴基斯坦巴里亚大学计算机科学系的Muhammad Asfand-e-yar, Qadeer Hashir & Waqar Khalil 、美国佛罗里达国际大学的Asghar Ali Shah 、沙特卡西姆大学的Hafiz Abid Mahmood Malik三位专家,他们在 AI 和生物信息学方面有着丰富的经验和成果。他们的研究受到了巴基斯坦高等教育委员会的资助,也得到了国际同行的认可和赞扬。他们的研究创新点主要有以下几个方面:
1)他们提出一种基于多模态 CNN 的 DDI 预测方法,该方法能够处理和融合不同类型的药物特征,如化学结构、酶、途径和靶点,从而实现对 DDI 的全面和准确的分析和预测。
2)他们采用一种基于 Jaccard 相似度的相似度矩阵作为 CNN 的输入,该相似度矩阵能够反映药物之间的相似性和差异性,从而提高 CNN 的学习能力和泛化能力。
3)他们设计一个新的 CNN 网络结构,该结构包括一个输入层,一个卷积层,一个展平层,三个全连接层和一个输出层,以及一些批量归一化层和丢弃层,用于提高模型的稳定性和防止过拟合。
4)他们使用 Adam 优化器和分类交叉熵损失函数来训练模型,这些都是目前深度学习领域的先进技术,能够提高模型的收敛速度和效果。
5)他们在 DrugBank 数据库上进行了广泛的实验,该数据库是目前最全面和最权威的药物数据库之一,包含了大量的药物和相互作用信息。他们对不同的超参数和特征组合进行了不同的实验,以找到最优的模型配置和特征选择。
6)他们还进行了两种不同的统计测试来评估他们的方法与其他方法的性能差异,这些测试能够客观地反映他们的方法的优越性和可靠性。
研究应用前景主要有以下几个方面。
- 他们的方法对于药物的安全性和有效性具有重要的意义,因为他们的方法能够帮助医生和药师避免不良的 DDI,从而提高药物治疗的质量和效果。他们的方法也为药物的开发和评价提供了一个有用的工具,可以加快药物的上市和推广。
- 他们的方法为药物的机制和功能的研究提供了一个新的视角和方法,可以揭示药物的复杂性和多样性。他们的方法也可以用于探索药物的新的相互作用和作用方式,从而发现新的药物或新的药物组合。
- 他们的方法也可以推广到其他领域,如基因、蛋白质、代谢物等,用于分析和预测它们之间的相互作用和功能。他们的方法也可以与其他 AI 技术,如自然语言处理、计算机视觉、语音识别等,结合起来,实现更多的多模态数据分析和应用。
背景和动机
药物间的相互作用(DDI)是指同时或先后服用两种或两种以上药物时,药物之间所产生的相互作用,而该相互作用可能会导致意想不到的副作用。例如,某些药物可能会增加或减少另一些药物的效果,或者引起新的不良反应,从而影响药物的安全性和有效性。DDI是临床药理学和药物治疗中一个重要的问题,也是导致药物不良事件和医疗成本增加的主要原因之一。
DDI的类型可以根据其发生的机制和结果进行分类。根据机制,DDI可以分为药效学相互作用和药动学相互作用。药效学相互作用是指一个药物通过相同或相反的药理作用,改变了另一个药物对组织或器官的影响。例如,阿司匹林和华法林都是抗凝血药,如果同时使用,可能会增加出血的风险。药动学相互作用是指一个药物改变了另一个药物在体内的吸收、分布、代谢或排泄,从而改变了另一个药物的浓度或生物利用度。例如,红霉素是一种抗生素,它可以抑制肝脏中的细胞色素P450酶,从而减少其他药物的代谢,导致其他药物的血药浓度升高。
根据结果,DDI可以分为协同作用和拮抗作用。协同作用是指两种或多种药物的联合使用,产生了比单独使用更强的效果。例如,抗癫痫药物卡马西平和苯妥英钠都可以增强γ-氨基丁酸(GABA)的抑制作用,如果同时使用,可以提高抗癫痫的效果。拮抗作用是指两种或多种药物的联合使用,产生了比单独使用更弱的效果。例如,抗生素青霉素和细胞壁合成抑制剂巴克替尔都可以抑制细菌的生长,如果同时使用,可以降低抗菌的效果⁵ 。
DDI的影响可以是有益的或有害的。有益的DDI可以提高药物的疗效或降低药物的毒性,从而优化药物治疗的效果。例如,抗结核药物利福平和异烟肼的联合使用,可以增强抗结核的效果,同时减少耐药性的发生。有害的DDI可以降低药物的疗效或增加药物的毒性,从而导致药物治疗的失败或不良事件的发生。例如,抗高血压药物利尿剂和非甾体抗炎药物的联合使用,可以降低利尿剂的降压效果,同时增加肾功能损害的风险 。
DDI的检测方法可以分为实验室方法和临床方法。实验室方法是指在体外或动物模型中,通过观察药物之间的化学反应或生物反应,来预测或验证DDI的可能性或程度。例如,通过测定药物对细胞色素P450酶的抑制或诱导作用,来评估药物对代谢酶的影响。临床方法是指在人体中,通过观察药物之间的药效或药动学参数的变化,来确定或评价DDI的存在或严重性。例如,通过测定药物的血药浓度或药效指标,来评估药物的相互作用 。
随着药物种类的增加和药物治疗的复杂化,DDI的发生率和危害性也越来越高,给临床医疗带来了巨大的挑战。因此,及时、准确、有效地预测DDI,对于保障药物的安全性和有效性,优化药物治疗的效果,降低药物不良事件和医疗成本,具有重要的意义。然而传统的DDI检测方法存在一些局限性,如耗时、耗费、不全面、不及时等,难以满足临床的需求。因此,利用人工智能(AI)技术,尤其是深度学习技术,来辅助DDI的预测,成为了近年来的研究热点和发展趋势 。
AI技术在DDI预测中的作用和挑战
AI技术利用计算机系统或其他智能设备,模拟或扩展人类的智能,实现各种复杂的任务的技术。AI技术包括多个子领域,如机器学习、深度学习、自然语言处理、计算机视觉、语音识别等。AI技术在医学领域有着广泛的应用,如医学影像分析、医学文本挖掘、医学诊断和决策支持、医学知识图谱构建等 。
AI技术利用多种数据源,如药物的化学结构、分子描述符、药物靶点、药物途径、药物标签、药物文献、药物数据库等,来提取和整合药物的多维特征,从而实现对药物的全面和深入的理解和表征。
AI技术使用多种模型和算法,如神经网络、图神经网络、卷积神经网络、循环神经网络、注意力机制、自编码器、生成对抗网络等,来建立和优化药物的预测模型,从而实现对DDI的精确和高效的预测和分类。
AI技术采用多种评估和验证方法,如准确率、召回率、精确率、F1分数、AUC、AUPR、混淆矩阵、ROC曲线、PR曲线、配对t检验、方差分析等,来评估和验证预测模型的性能和可靠性,从而实现对DDI的客观和科学的评价和分析。
方法和原理
多模态卷积神经网络 (MCNN) 是一种能够处理和融合不同模态数据的深度学习方法。模态是指数据的类型,如文本、图像、音频、视频等。不同模态的数据包含了不同的信息和特征,通过有效地结合它们,可以实现对复杂问题的更全面和准确的理解和分析。
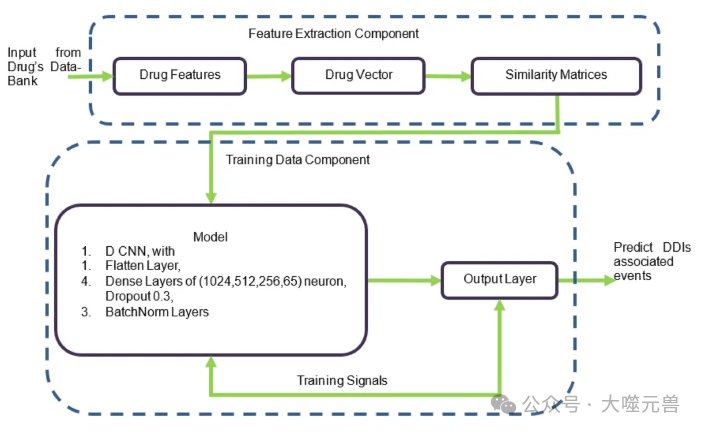 图1:DDI 的框架架构。
图1:DDI 的框架架构。
MCNN 的核心思想是使用多列并行的卷积神经网络 (CNN) 来提取不同模态数据的特征,并将它们融合为一个统一的输出。每列 CNN 的卷积核大小不同,以适应不同模态数据的特征尺度。MCNN 可以根据不同的任务和数据集,灵活地设计不同的网络结构和参数。
论文作者的方法是基于 MCNN 的 DDI 预测方法,该方法利用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。论文作者的方法的具体步骤和细节如下:
第一步,提取药物特征。论文作者从 DrugBank 数据库中获取了 572 种药物的信息,包括它们的化学结构(以 SMILES 表示)、酶、途径和靶点等。论文作者使用编码层将每种药物的信息转换为一个位向量,其中 1 表示药物中存在该化合物,0 表示不存在该化合物。例如,酶可以由 202 维的位向量表示,靶点可以由 1162 维的位向量表示,化学子结构可以由 808 维的位向量表示。
第二步,计算药物对的相似性。论文作者使用 Jaccard 相似度来计算每对药物之间的相似性,该相似度是指两个集合的交集与并集的比值。论文作者将每种药物的位向量视为一个集合,然后计算它们的交集和并集的大小,从而得到相似度矩阵。相似度矩阵的大小为 572 x 572,其中每个元素表示一对药物的相似度,范围在 0 到 1 之间。相似度矩阵可以反映药物之间的相似性和差异性,从而有助于 CNN 学习药物的特征和相互作用。
第三步,构建多模态 CNN 网络。论文作者使用四个并行的 CNN 子模型来处理不同的药物特征,即化学结构、酶、途径和靶点。每个 CNN 子模型的结构如下:
- 输入层:接收相似度矩阵作为输入,大小为 572 x 572 x 1。
- 卷积层:使用不同的卷积核大小和滤波器数量来提取特征,例如,化学结构使用 5 x 5 的卷积核和 32 个滤波器,酶使用 3 x 3 的卷积核和 16 个滤波器,途径使用 7 x 7 的卷积核和 64 个滤波器,靶点使用 9 x 9 的卷积核和 128 个滤波器。卷积层使用“tanh”作为激活函数,以同时使用正值和负值,因为相似度矩阵中可能存在负值。
- 展平层:将卷积层的输出转换为一维的向量,以便输入到全连接层。
- 全连接层:使用三个全连接层,分别有 1024、512 和 256 个神经元,用于进一步提取和融合特征。全连接层使用“elu”作为激活函数,以增加非线性和稳定性。全连接层还使用批量归一化层和丢弃层,以防止过拟合和加速收敛。
- 输出层:使用一个全连接层,有 65 个神经元,对应于 65 种不同的 DDI 相关事件。输出层使用“SoftMax”作为激活函数,以输出每种事件的概率分布。
第四步,融合多模态 CNN 的输出。论文作者使用一个全连接层,将四个 CNN 子模型的输出融合为一个统一的输出,大小为 65 x 1,表示每种 DDI 相关事件的预测概率。论文作者使用“SoftMax”作为激活函数,以保证输出的概率之和为 1。
第五步,训练和评估多模态 CNN 网络。论文作者使用 Adam 优化器和分类交叉熵损失函数来训练模型,这些都是目前深度学习领域的先进技术,能够提高模型的收敛速度和效果。论文作者使用准确率、精确率、召回率、F1 分数和 AUPR 等评估指标来评估模型的性能,这些指标可以反映模型的准确性、灵敏度、特异度和平衡性。论文作者还使用配对 t 检验和方差分析来评估模型与其他方法的性能差异,这些检验可以反映模型的显著性和可信度。
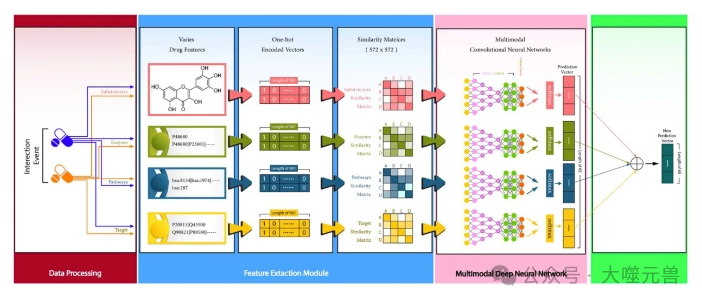 图2:所提出的模型命名为MCCN-DDI。
图2:所提出的模型命名为MCCN-DDI。
实验和结果
论文作者在 DrugBank 数据库上进行了广泛的实验,该数据库是目前最全面和最权威的药物数据库之一,包含了大量的药物和相互作用信息。作者使用了 572 种药物和 74528 个相互作用作为数据集,其中 80% 用于训练,10% 用于验证,10% 用于测试。作者对不同的超参数和特征组合进行了不同的实验,以找到最优的模型配置和特征选择。
作者使用准确率、精确率、召回率、F1 分数和 AUPR 等评估指标来评估模型的性能,这些指标可以反映模型的准确性、灵敏度、特异度和平衡性。论文作者的实验结果如表 3 所示,其中展示了单个特征和一组特征的结果。从表 3 中可以看出,化学结构是最重要的药物特征,其准确率达到了 0.8861,而酶是最不重要的药物特征,其准确率仅为 0.6808。当使用两组或三组特征时,模型的性能有所提高,其中化学结构、靶点和酶的组合达到了最高的准确率 0.9000。然而,当使用所有四组特征时,模型的性能反而有所下降,其准确率为 0.8953。这可能是因为特征之间存在一定的冗余或噪声,导致模型过拟合或混淆。
论文作者还使用配对 t 检验和方差分析来评估模型与其他方法的性能差异,这些检验可以反映模型的显著性和可信度。作者将他们的方法与以下几种方法进行了比较。
DDIMDL:这是一种基于多模态深度神经网络的 DDI 预测方法,使用了药物的化学结构、酶、途径和靶点等特征,以及基于余弦相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。
DeepDDI:这是一种基于深度神经网络的 DDI 预测方法,使用了药物的分子描述符和指纹等特征,以及基于欧氏距离的相似度矩阵,来预测 86 种不同的 DDI 相关事件。
RF:这是一种基于随机森林的 DDI 预测方法,使用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。
KNN:这是一种基于 K 最近邻的 DDI 预测方法,使用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。
LR:这是一种基于逻辑回归的 DDI 预测方法,使用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。
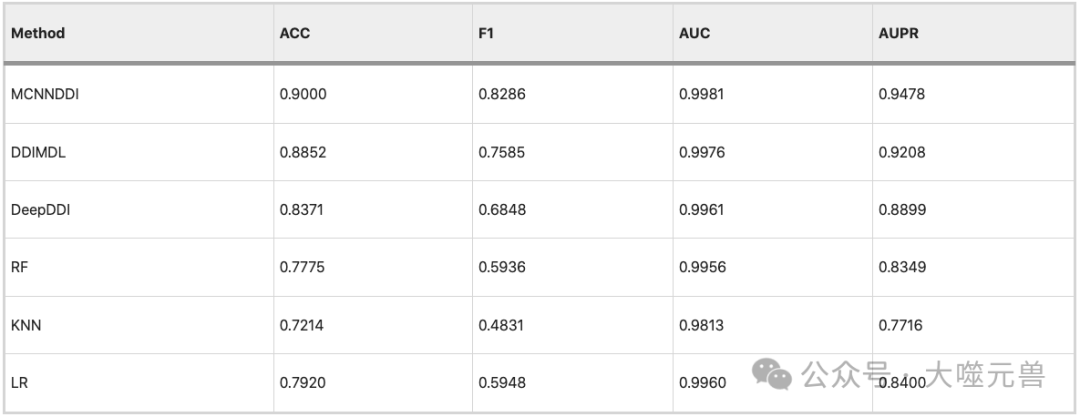 论文表4:MCNN-DDI与其他模型的结果比较。
论文表4:MCNN-DDI与其他模型的结果比较。
论文作者的比较结果如论文表 4 所示,其中展示了不同方法在不同评估指标上的表现。从表 4 中可以看出,作者的方法在所有评估指标上均优于其他方法,而 LR 方法与其他方法的相关性较差。作者的方法实现了高精度,AUPR 值分别为 0.9000 和 0.9478,证明了其优越性。配对 t 检验和方差分析的结果表明,作者的方法与其他方法之间的性能差异是显著的和稳定的,具有统计学意义。
讨论和总结
使用多模态 CNN-DDI处理药物间相互作用的研究是一项重要的 AI 领域医学应用,他们提出了一种基于多模态 CNN 的 DDI 预测方法,该方法利用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。他们的方法在准确率和 AUPR 等评估指标上均优于其他方法,并且能够有效地识别不同类型的 DDI。他们的方法对于药物的安全性和有效性具有重要的意义,也为药物的机制和功能的研究提供了一个新的视角和方法。
他们的研究对于药物的安全性和有效性具有重要的意义,因为他们的方法能够帮助医生和药师避免不良的 DDI,从而提高药物治疗的质量和效果。他们的方法也为药物的开发和评价提供了一个有用的工具,可以加快药物的上市和推广。他们为药物的机制和功能的研究提供了一个新的视角和方法,可以揭示药物的复杂性和多样性。他们的方法也可以用于探索药物的新的相互作用和作用方式,从而发现新的药物或新的药物组合。他们为 AI 领域的多模态深度学习提供了一个新的应用场景和案例,展示了多模态 CNN 的强大能力和潜力。他们的方法也可以推广到其他领域,如基因、蛋白质、代谢物等,用于分析和预测它们之间的相互作用和功能。他们的方法也可以与其他 AI 技术,如自然语言处理、计算机视觉、语音识别等,结合起来,实现更多的多模态数据分析和应用。
论文作者的研究是一项重要的 AI 领域医学应用,他们提出了一种基于多模态 CNN 的 DDI 预测方法,该方法利用了药物的化学结构、酶、途径和靶点等特征,以及基于 Jaccard 相似度的相似度矩阵,来预测 65 种不同的 DDI 相关事件。他们的方法在准确率和 AUPR 等评估指标上均优于其他方法,并且能够有效地识别不同类型的 DDI。他们的方法对于药物的安全性和有效性具有重要的意义,也为药物的机制和功能的研究提供了一个新的视角和方法。他们的研究具有创新性、局限性和前景性,值得我们进一步关注。
参考资料:https://www.nature.com/articles/s41598-024-54409-x


发表评论 取消回复